茂呂 和世先生MORO KAZUYO
【現在の所属】
大阪大学医学系研究科 生体防御学教室 教授(本務)
理化学研究所 生命医科学研究センター 自然免疫システム チームリーダー(兼務)
大阪大学免疫学フロンティア研究センター(IFReC)
免疫・アレルギー教室 教授(兼務)
大阪大学大学院生命機能研究科 生体防御学教室 教授(兼務)
【受賞当時の所属】
理化学研究所 統合生命医科学研究センター チームリーダー
平成15年日本大学歯学部歯学科卒業。
平成19年慶應義塾大学医学研究科博士課程単位取得満期退学。
平成24年理化学研究所IMS上級研究員(H24~H27)/チームリーダー(H27~現任)。
平成31年大阪大学医学系研究科生体防御学教室教授(現任・本務)。
2型自然リンパ球(Group 2 innate lymphoid cell: ILC2)の発見
2025.01.10
2018年に永瀬賞をいただき、あっという間に7年が過ぎました。永瀬賞の受賞は、私自身の励みとなっただけでなく、周囲の若手研究者に努力はいつか報われるという希望を与えてくれました。これは、研究者を目指す若者が減少している現状において、特に感謝したい点です。
私の受賞研究は、2型自然リンパ球(Group 2 innate lymphoid cell: ILC2)という新しいリンパ球の発見に関するものでした。ILC2は、T細胞やB細胞のように抗原を認識する機能を持たず、自然免疫に属する細胞です。ILC2は組織傷害や炎症によって上皮細胞から放出されるIL-33というサイトカインに反応します。IL-33は、損傷した細胞から放出される『危機シグナル』として働き、ILC2はこのIL-33の刺激を受けることで、2型サイトカインと呼ばれる液性因子を産生し、2型免疫応答を誘導します。2型免疫応答は二面性を持っています。寄生虫や真菌感染時には病原体の排除を促し、生体にとって有益に働きます。一方で、ILC2の研究が進むにつれ、感染症が少なくなった先進国では役割を失ったILC2が暴走し、アレルギーを誘導することも明らかになりました。このため、受賞当時の我々の展望は、ILC2を標的とすることでアレルギーを制御できる薬の開発でした。
この夢は多くの企業の努力によってすでに実現されています。ILC2の上流や下流のサイトカインをターゲットとした様々な生物製剤が臨床で使用され、素晴らしい成果を挙げています。例えば、抗IL-4/13受容体抗体はIL-4とIL-13というサイトカインの作用を阻害し、アトピー性皮膚炎や喘息の症状を抑える効果があります。抗IL-5抗体および抗IL-5受容体抗体はIL-5のシグナル伝達を遮断し、好酸球性炎症を軽減することで喘息や好酸球性疾患を改善します。抗TSLP抗体は上皮細胞から放出されるサイトカインTSLPを阻害し、炎症反応の抑制を通じて喘息の管理に有効です。これらの抗体製剤は目覚ましい治療効果を示し、アレルギーに悩んできた患者さんの人生を大きく変えることもしばしばです。しかし、抗体製剤は高額であり、すべての患者さんが気軽に受けられる治療ではないことが課題です。また、投与をやめるとアレルギーが再発することも問題視されています。そのため、次の10年間の課題は、再発のない安価なアレルギー治療薬の開発です。
COVID-19パンデミックは免疫学界に大きな衝撃を与えました。これまでウイルス研究を専門としていなかった多くの研究者が新たにこの分野へ参入し、次々と革新的な発見が報告されました。ILC2とウイルスに関する新しい知見もその一例です。一般に、国の経済が衰退すると研究予算も減少すると懸念されていますが、今回のパンデミックでは世界各国がウイルス研究への投資を大幅に強化し、ウイルス学は異例の発展を遂げました。一方で、新興・再興感染症のリスクについては以前から多くの研究者が警鐘を鳴らしていたにもかかわらず、危機が現実化するまで十分な対応がとられなかったことも浮き彫りとなりました。感染症研究への投資が依然として後手に回る現状が露呈したといえるでしょう。
従来、ILC2はウイルス感染症においてほとんど役割を果たさない細胞と考えられていました。しかし、インフルエンザウイルスやRSウイルスなどの呼吸器感染症モデルを用いた最近の研究により、T細胞やNK細胞がウイルスと戦った後に荒廃した肺組織の修復を担う重要な役割を果たすことが明らかになっています。実際に、ILC2が欠損したマウスやILC2を活性化するIL-33を欠くマウスでは、ウイルス感染後の死亡率が有意に上昇し、組織修復の重要性が改めて示されました。
この組織修復にも二面性があることが最近明らかになりました。修復過程ではコラーゲン産生が重要ですが、ILC2は線維芽細胞を助けることでコラーゲン産生を促進し、傷を修復します。しかし、ILC2が過剰に働くとコラーゲン産生が過剰になり、線維化が引き起こされます。遺伝子操作によりILC2を活性化しやすくしたマウスでは、特発性間質性肺炎という肺線維症が発症することが示されました。肺線維症は、肺が過剰にコラーゲンを蓄積し硬くなる病気で、呼吸困難や肺機能の低下を引き起こします。難治性の疾患で慢性化すると生命に関わることもあります。しかし、有効な薬がないため、研究者、臨床医、製薬会社が新規治療薬の開発を求めています。現在、ILC2を標的とした治療法が線維化の進行を抑制できるかどうかが期待されています。
最後に、ILC2を報告してから15年が経ちました。この間、ILC2は感染症やアレルギーだけでなく、線維症、炎症性腸疾患、がん、自己免疫疾患といった多岐にわたる疾患に関与することが明らかになり、これまでの研究の積み重ねによって新たな治療法の可能性が広がりつつあります。研究は、何気ない疑問から始まり、探求を重ねる過程で小さな喜びや大きな驚き、そして失望を繰り返しながら進んでいくものです。自分しか知らない科学の秘密が論文として世界中に広がり、異なる視点を持つ研究者たちの手によってさらに発展していく。その素晴らしさは、他の職業では味わえない醍醐味です。安定が重視される世の中ですが、研究には良い時と悪い時が程よく交互に訪れ、人生に刺激と充実感を与えてくれます。だからこそ、もっと多くの若い人たちに研究の魅力を感じてもらい、気負わずにこの世界に飛び込んでほしいと心から願っています。
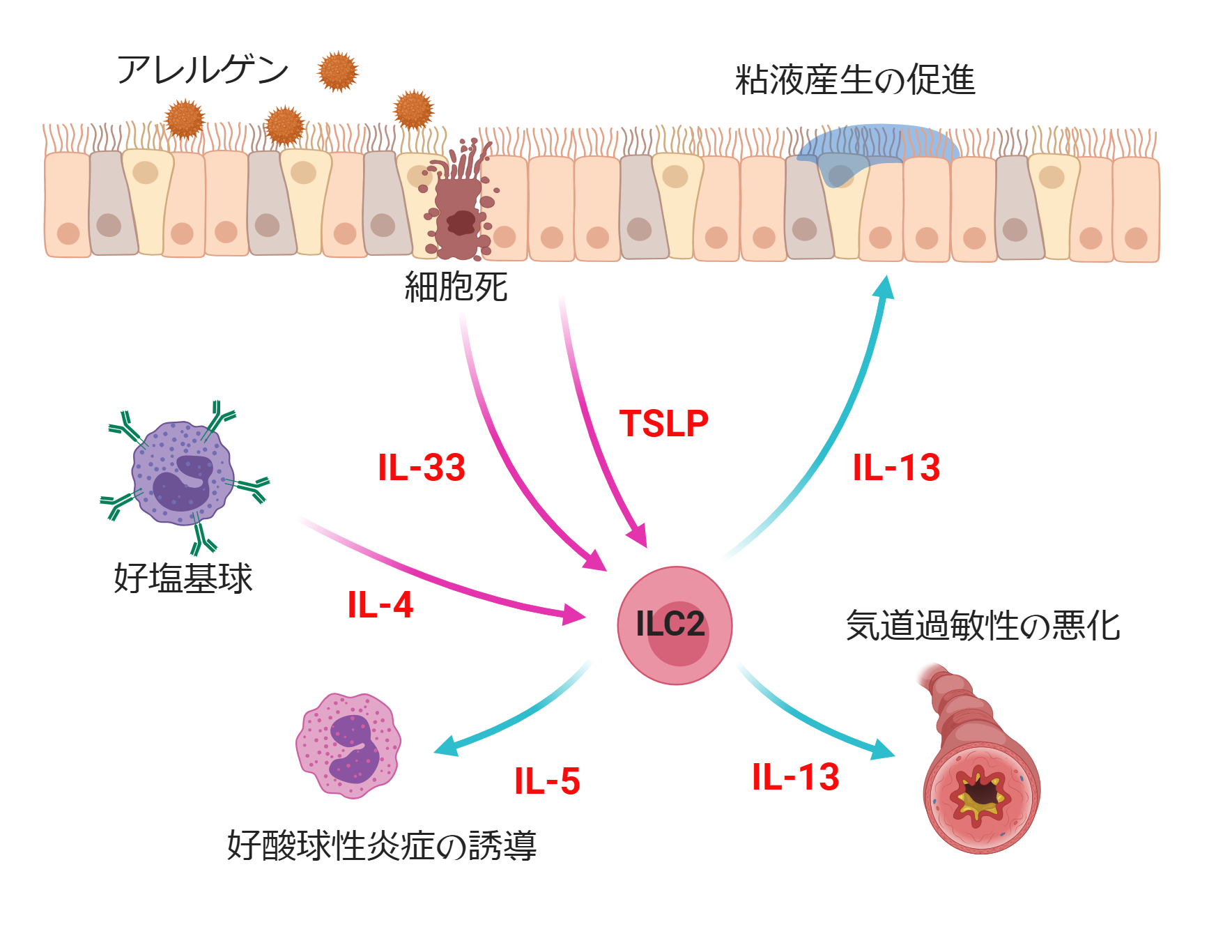
図1, ILC2の活性化には様々な液性因子が関与しますが、ILC2の活性化に関わる因子の中でもIL-4とTSLPはすでにアレルギーの治療に使われています。ILC2が産生するIL-5は好酸球を誘導することでアレルギーを悪化させます。また、IL-13は気道過敏性を上げたり、粘液産生を促進したりすることで、咳や痰などを誘導します。これらのILC2下流のサイトカインもすでにアレルギーの治療標的として有効です。

